17live 王锐院士团队在Science Advances报道手性药物重要进展
近日,17live 院士工作站-转化医学与药物研究中心王锐院士/李国锋助理教授联合中山大学药学院洪亮教授在Science子刊《Science Advances》上发表了题为“Chiral sodium complex–catalyzed asymmetric cascade cycloaddition/hydration/1,2-rearrangement”的研究论文。17live 药学院助理教授张明与中山大学博士研究生韦源林为论文共同第一作者,17live 王锐、李国锋和中山大学洪亮为本文共同通讯作者。
手性药物在临床治疗中的重要性日益凸显,其不同对映异构体在疗效与安全性上的显著差异已受到临床的广泛关注。其中,含氮稠环异喹啉骨架是一类重要的优势结构,广泛存在于具有显著生物活性的天然产物及多项临床应用中,涵盖抗肿瘤、神经精神系统疾病治疗及抗感染等多个领域。该结构因其可与多种生物靶点发生高亲和力相互作用,被视为极具开发潜力的药效团。然而,针对此类复杂多环体系的传统构建策略,常受限于立体选择性控制不足、合成路线冗长、手性催化剂成本高昂以及难以实现规模化生产等问题,严重制约了该类结构在药物发现与开发中的高效应用。
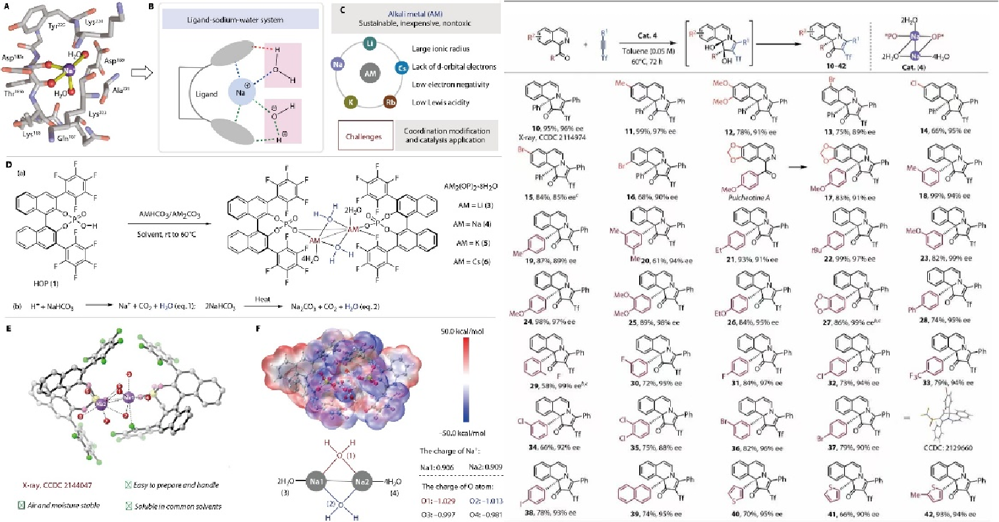
研究团队受自然界中钠离子精密调控酶催化过程的启发,创新性地设计了一类基于多氟磷酸阴离子与水分子协同配位的手性钠配合物催化剂。基于该催化剂,团队成功开发了α-酮亚胺的高效不对称级联反应,经由串联的环加成/水合/1,2-重排过程,实现了多种含氮稠合多环异喹啉类化合物的高对映选择性合成(ee值普遍>90%)。
该研究不仅首次系统阐释了碱金属钠在仿生不对称催化中的独特潜力-突破其仅作为辅助平衡离子或结构稳定剂的传统角色,更为发展基于储量丰富、成本低廉的主族金属手性催化剂体系提供了全新范式。尤为重要的是,该催化策略所构建的手性多环化合物库,兼具优异的立体化学精确性与显著的分子结构多样性,为药物化学家针对肿瘤、神经退行性疾病等重大疾病靶点开展先导化合物筛选与优化,提供了大量具有高类药性的新颖骨架,展现出重要的转化应用前景。这一成果也为后续基于优势结构的定向药物发现研究提供了有力的合成工具与结构基础。
该研究受到国家自然科学基金面上项目、深圳市医学研究专项资金、广东省基础与应用基础研究基金、17live 青年教师启动基金等的资助。
原文链接://www.science.org/doi/10.1126/sciadv.ady4294










用户登录
还没有账号?
立即注册